Principi farmakološkog liječenja KOPB-a s osvrtom na novosti prema GOLD-u 2023.
Autor: Vide Popović, dr. med., specijalist pulmologije, KBC Split, Klinika za plućne bolesti
Uvod
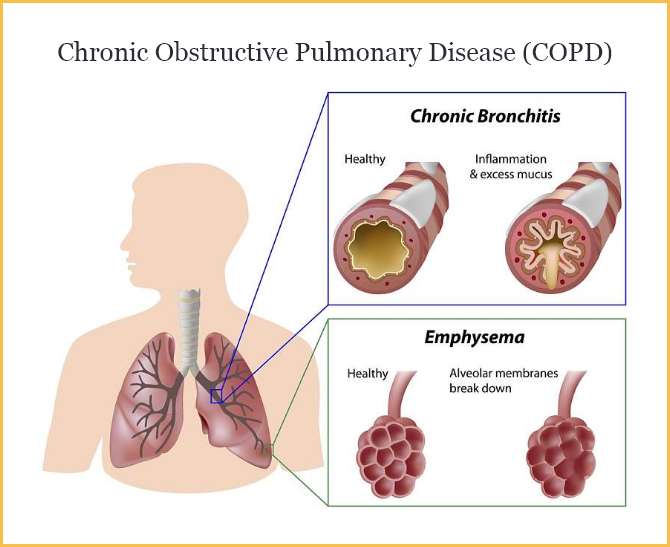
Kronična opstruktivna plućna bolest (KOPB) je heterogena bolest pluća karakterizirana kroničnim respiratornim simptomima (dispneja, kašalj, stvaranje sputuma i egzacerbacije) zbog abnormalnosti dišnih putova (bronhitis, bronhiolitis) i/ili alveola (emfizem) koji uzrokuju trajnu, često progresivnu opstrukciju protoka zraka (1). KOPB je rezultat interakcija gena i okoliša koji se javljaju tijekom životnog vijeka pojedinca i koji mogu oštetiti pluća i promijeniti njihov normalan razvoj i proces starenja (2). Glavni uzročnik koji dovodi do KOPB-a je pušenje duhana, ali su važni i ostali poput udisanja štetnih čestica i plinova u radnom okolišu i kućanstvu, kao i čimbenici od strane domaćina koji uključuju abnormalni razvoj pluća i ubrzano starenje pluća (2, 3). Najpoznatiji genetski čimbenik rizika za KOPB je mutacija u genu SERPINA1 koji dovodi do nedostatka α1-antitripsina, ali su poznate i druge genetske varijante povezane sa smanjenom funkcijom pluća i rizikom od KOPB-a (4). U odgovarajućem kliničkom kontekstu prisutnost nepotpunog reverzibilnog ograničenja protoka zraka (FEV1/FVC < 0,7 nakon bronhodilatacije) mjereno spirometrijom potvrđuje dijagnozu KOPB-a. Bolesnici koji imaju strukturne lezije pluća (npr. emfizem) i fiziološke abnormalnosti (niži FEV1, hiperinflaciju, smanjeni kapacitet difuzije pluća ili brzi pad FEV1), a bez kritične opstrukcije protoka zraka (FEV1/FVC ≥ 0,7 nakon bronhodilatacije) označeni su kao „pre–KOPB bolesnici“. Neki od bolesnika s pre-KOPB-om tijekom vremena razvijaju opstrukciju dišnih putova, ali ne svi (5,6). Potrebna su dodatna istraživanje kako bi se utvrdilo koji je, uz prestanak pušenja, najbolji oblik liječenja za ove bolesnike.
Bolesnici s KOPB-om obično se žale na dispneju, piskanje, stezanje u prsima, umor, ograničenje aktivnosti i kašalj s ili bez proizvodnje sputuma te mogu doživjeti akutne egzacerbacije karakterizirane intenziviranjem dispneje i drugih tegoba koje utječu na njihovo zdravstveno stanje i prognozu te zahtijevaju specifične terapijske i preventivne mjere. Bolesnici s KOPB-om često imaju druge popratne bolesti koje također utječu na njihovo kliničko stanje i prognozu te zahtijevaju odgovarajuće liječenje. Komorbiditeti mogu oponašati i/ili pogoršati egzacerbaciju. KOPB je vodeći uzrok morbiditeta i mortaliteta diljem svijeta s ekonomskim i društvenim teretom koji je i značajan i u porastu (7,8).
Prevalencija KOPB-a, morbiditet i mortalitet razlikuju se među zemljama (9,10). Prevalencija KOPB-a često je izravno povezana s prevalencijom pušenja duhana. Predviđa se kako će se prevalencija i teret KOPB-a, tijekom sljedećih desetljeća, još povećati zbog kombinacije kontinuirane izloženosti različitim čimbenicima rizika za KOPB i starenja svjetske populacije (11). Postojeći podaci o prevalenciji KOPB-a uvelike variraju zbog razlika u metodama istraživanja, dijagnostičkim i analitičkim kriterijima (12). Treba napomenuti kako su sve epidemiološke studije definirale KOPB samo spirometrijom, a ne kombinacijom simptoma i spirometrije. Najniža prevalencija temeljena je na samoprijavljivanju bolesnika te liječničkoj dijagnozi KOPB-a. Npr., većina nacionalnih podataka pokazuje da manje od 6 % odraslih u populaciji imaju KOPB (13). Pojavljuju se podaci koji omogućuju točnije procjene prevalencije KOPB-a. Niz sustavnih pregleda i meta-analiza pružaju dokaze kako je prevalencija KOPB-a znatno veća u pušača i bivših pušača u usporedbi s nepušačima te u starijih od 40 godina u odnosu na mlađe, kao i u muškaraca u usporedbi sa ženama (14). Mjere morbiditeta tradicionalno uključuju posjete liječniku, posjete hitnoj službi i hospitalizacije. Studije pokazuju da pobol od KOPB-a raste s dobi te da može biti pod utjecajem popratnih bolesti poput kardiovaskularnih, mišićno-koštanih i dijabetesa, a koje se u bolesnika s KOPB-om javljaju u ranijoj dobi (15). Svjetska zdravstvena organizacija (SZO) svake godine objavljuje statistiku smrtnosti za odabrane uzroke smrti, međutim, podaci se za KOPB moraju tumačiti s oprezom zbog nedosljedne uporabe terminologije KOPB-a (16). U 10. reviziji Međunarodne statističke klasifikacije bolesti i srodnih zdravstvenih problema (ICD-10) KOPB uključuje široku kategoriju „KOPB-a i srodnih stanja“ (ICD-10). Nedovoljno prepoznavanje i dijagnosticiranje KOPB-a smanjuje točnost podataka o smrtnosti (17). Smrtnost povezana s KOPB-om također je problematična jer se KOPB, iako primarni uzrok smrti, češće navodi kao dodatni uzrok smrti ili potpuno izostavlja iz smrtovnice (18).
Simptomi i dijagnoza
Dijagnozu KOPB-a treba razmotriti kod svakog bolesnika koji ima dispneju, kronični kašalj ili stvaranje sputuma i/ili povijest izloženosti čimbenicima rizika za bolest, a spirometrijski nalaz koji pokazuje prisutnost postbronhodilatatornog FEV1/FVC < 0,7 obvezan je za postavljanje dijagnoze KOPB-a (19). Kronična dispneja najkarakterističniji je i najvažniji simptom KOPB-a. Kašalj s iskašljavanjem sputuma prisutan je u do 30 % pacijenata. Ovi simptomi mogu varirati iz dana u dan i mogu prethoditi razvoju opstrukcije protoka zraka tako što se jave godinama ranije (20). Pojedinci, osobito oni s čimbenicima rizika za KOPB koji imaju ove simptome, trebali bi biti obrađeni kako bi se istražio temeljni uzrok. Opstrukcija protoka zraka također može biti prisutna bez kronične dispneje i kašlja s iskašljavanjem sputuma i obrnuto (21). U praksi se odluka o traženju liječničke pomoći obično određuje zbog utjecaja simptoma na funkcionalno stanje bolesnika. Bolesnici traže liječničku pomoć ili zbog kroničnih respiratornih simptoma ili zbog akutnog, prolaznog pogoršanja respiratornih simptoma.
Dispneja je glavni simptom KOPB-a i glavni uzrok invaliditeta i tjeskobe povezanih s bolešću (22). Dispneja se sastoji od senzorne i afektivne komponente. Pacijenti s KOPB-om tipično opisuju dispneju kao osjećaj pojačanog napora pri disanju, težinu u prsima, glad za zrakom ili dahtanje. Izrazi koji se koriste za opisivanje dispneje mogu varirati i individualno i kulturološki. U početku se javlja tijekom napora ili tjelesne aktivnosti. Umjerenu do tešku dispneju prijavilo je više od 40 % pacijenata kojima je dijagnosticiran KOPB u primarnoj zdravstvenoj zaštiti (23). Dispneja je složena i višestruki mehanizmi mogu biti uključeni u njenu patogenezu, uključujući oštećenje respiratorne mehanike kao posljedicu opstrukcije protoka zraka i hiperinflacije pluća, poremećaje izmjene respiratornih plinova, perifernu mišićnu disfunkciju povezanu s dekondicioniranjem (i sustavnom upalom kod nekih pacijenata) te psihološki stres i disfunkcionalno disanje, kao i kardiovaskularne ili druge popratne bolesti (24, 25).
Kronični je kašalj često prvi simptom KOPB-a i pacijenti ga često zanemaruju i tretiraju kao očekivanu posljedicu pušenja i/ili pripisuju drugim okolišnim čimbenicima rizika. U početku kašalj može biti povremen, ali kasnije je često prisutan tijekom cijelog dana. Kronični kašalj u KOPB-u može biti produktivan ili neproduktivan. U nekim se slučajevima može razviti značajna opstrukcija protoka zraka bez prisutnosti kašlja. Sinkopa u bolesnika s teškim KOPB-om može nastati zbog brzog porasta intratorakalnog tlaka tijekom teških i/ili dugotrajnih napada kašlja. Napadi kašlja mogu uzrokovati prijelome rebara koji su ponekad asimptomatski. Pacijenti s KOPB-om obično iskašljavaju male količine žilavog sekreta. Produktivni kašalj s iskašljavanjem tijekom tri ili više mjeseci u dvije uzastopne godine je klasična definicija kroničnog bronhitisa koja neprecizno odražava cjelokupni opseg proizvodnje sputuma. Količinu stvorenog sputuma često je teško procijeniti jer mnogi bolesnici ne iskašlju nego progutaju sekret, a to je podložno navikama koje su povezane s kulturalnim i spolnim varijacijama. U bolesnika koji proizvode velike količine sputuma treba razmišljati o bronhiektazijama u podlozi (26). Prisutnost gnojnog sputuma može označavati početak bakterijske egzacerbacije koja može biti praćena povećanjem upalnih parametara, iako je povezanost istih relativno slaba (27).
Zviždanje pri udisaju i/ili izdisaju i stezanje u prsima su simptomi koji mogu varirati između više dana i tijekom jednog dana. Auskultacijski se mogu čuti inspiratorni ili ekspiratorni zvižduci. Stezanje u prsima često slijedi nakon napora, netipično je lokalizirano, a može nastati zbog izometrijske kontrakcije interkostalnih mišića (28).
Subjektivni osjećaj umora ili iscrpljenosti je jedan od najčešćih simptoma koji je uznemirujući za osobe s KOPB-om (29). Osobe s KOPB-om opisuju svoj umor kao osjećaj „općeg umora“ ili kao osjećaj „iscrpljenosti energije“. Umor utječe na pacijentovu sposobnost obavljanja svakodnevnih životnih aktivnosti kao i na cjelokupnu kvalitetu života.
Gubitak tjelesne težine, poglavito gubitak mišićne mase važan je problem kod dijela bolesnika s teškim i vrlo teškim KOPB-om (30). Sarkopenija ima prognostičku važnost bolesnika s KOPB-om, a može biti i znak drugih bolesti, poput tuberkuloze ili raka pluća.
Otok gležnjeva i potkoljenica može ukazivati na dekompenzaciju plućnog srca. Simptomi depresije i/ili anksioznosti česti su u bolesnika s KOPB-om, povezani su s lošijim zdravstvenim stanjem, povećanim rizikom od egzacerbacija i hitnog prijema u bolnicu te se moraju odgovarajuće liječiti (31).
Fizikalni znakovi prilikom kliničkog pregleda obično nisu prisutni sve dok ne dođe do težeg oštećenja funkcije pluća i imaju relativno nisku osjetljivost i specifičnost (32). Niz fizikalnih znakova (npr. cijanoza) može se naći u bolesnika s KOPB-om, ali njihov izostanak ne isključuje dijagnozu.
Forsirana spirometrija je najreproducibilnije i najobjektivnije mjerenje opstrukcije protoka zraka kroz dišne putove. Ova je pretraga neinvazivna, ponovljiva i lako dostupna. Svi zdravstveni radnici koji skrbe o osobama s KOPB-om trebali bi imati pristup kvalitetnoj spirometriji. Treba napomenuti da korištenje fiksnog omjera FEV1/FVC < 0,7 za definiranje protoka zraka opstrukcija može rezultirati pretjeranom dijagnozom KOPB-a u starijih osoba i nedovoljno postavljenom dijagnozom u mlađih odraslih osoba, osobito kod blage bolesti, u usporedbi s korištenjem granične vrijednosti temeljene na donjoj granici normalnih vrijednosti (LLN)za FEV1/FVC (33). Vrijednosti LLN-a temelje se na normalnoj distribuciji i klasificiraju donjih 5 % zdrave populacije kao abnormalne. Važno je naglasiti da opstrukcija protoka zraka koja nije potpuno reverzibilna nije tipična za KOPB i može se naći u bolesnika s astmom i drugim bolestima. Postoji veliki rizik od pogrešne dijagnoze i pretjeranog liječenja pojedinih pacijenata ukoliko se oslanja na spirometrijski dijagnostički kriterij fiksnog omjera, a bez odgovarajućeg kliničkog konteksta vezano uz simptome i čimbenike rizika. Stoga GOLD daje prednost korištenju fiksnog omjera prema LLN vrijednostima. Procjenu prisutnosti ili odsutnosti opstrukcije protoka zraka temeljenu na jednom mjerenju postbronhodilatacijskog omjera FEV1/FVC treba potvrditi ponovljenom spirometrijom u drugoj prilici ako je vrijednost između 0,60 i 0,80 budući da se u nekim slučajevima omjer može promijeniti kao rezultat biološke varijacije kada se mjeri kasniji interval (34). Ako je početni postbronhodilatacijski omjer FEV1/FVC manji od 0,60, malo je vjerojatno da će spontano porasti iznad 0,7. Važno je napomenuti kako je u bolesnika iz kohorte SPIROMICS, u kojoj je prebronhodilatatorni omjer FEV1/FVC bio < 0,7, ali je povećan na ≥ 0,7 nakon inhalacijskih bronhodilatatora, rizik od budućeg razvoja KOPB-a u usporedbi s referentnom skupinom bez opstrukcije 6,2 puta veći (35). Dok je spirometrija nakon bronhodilatacije potrebna za dijagnozu i procjenu KOPB-a, procjena stupnja reverzibilnosti opstrukcije protoka zraka (npr. mjerenje FEV1 prije i poslije bronhodilatatora ili kortikosteroida) za terapijsku odluku se više ne preporučuju. Stupanj reverzibilnosti kod jednog bolesnika varira tijekom vremena i nije dokazano da dijagnozu razlikuje od astme ili da predviđa odgovor na dugotrajno liječenje s bronhodilatatorima ili kortikosteroidima (36). Sukladno tome, nije potrebno prekinuti inhalacijski lijek prije novog spirometrijskog mjerenja tijekom praćenja bolesnika.
Difuzijski kapacitet (DLCO) mjerenje jednog udisaja procjenjuje svojstva prijenosa plinova dišnog sustava. DLCO je dobro standardiziran i s valjanim predviđenim vrijednostima praktične korisnosti (37). DLCO treba izmjeriti kod svake osobe sa simptomom dispneje koja je nerazmjerna stupnju opstrukcije protoka zraka. Smanjene vrijednosti DLCO-a manje od 60 % povezane s pojačanim simptomima, smanjenom sposobnošću vježbanja, lošijim zdravstvenim statusom i povećanim rizikom od smrti, neovisno o težini opstrukcije protoka zraka kao i drugim kliničkim varijablama (38, 39). U bolesnika s KOPB-om, niske vrijednosti DLCO-a predstavljaju kontraindikaciju za kiruršku resekciju pluća u pacijenata s rakom pluća, dok u pušača koji spirometrijski nemaju potvrđen KOPB ukazuju na povećan rizik za razvoj KOPB-a tijekom vremena (40). Bolesnici s KOPB-om i u usporedbi s pušačima bez ove bolesti, tijekom vremena imaju ubrzani pad DLCO-a i taj pad je značajno veći u žena nego kod muškaraca (41).
Pulsna oksimetrija može se koristiti za procjenu pacijentove arterijske saturacije kisikom i potrebe za oksigenoterapijom i treba je koristiti u svih bolesnika s kliničkim znakovima koji upućuju na respiratorno zatajenje ili zatajenje desnog srca. Ako periferna arterijska saturacija kisikom iznosi 92 % ili manje, nužno je učiniti plinsku analizu arterijske krvi zbog nesavršene korelacije između zasićenosti kisikom otkrivene putem pulsne oksimetrije u usporedbi s arterijskom krvlju (42). Pulsna oksimetrija također ne daje podatke o PaCO2 ili pH-u, koji mogu biti od važnosti za potencijalno terapijsko djelovanje ili ukazivati na potrebu neinvazivne ventilacije. U nekim slučajevima, pacijenti mogu imati male simptome unatoč teškom oštećenju plućne funkcije. Razlog za to može biti smanjena percepcija dispneje ili prilagodba načina života (sjedenje) kako bi se smanjila potencijalna dispneja. U ovim slučajevima, testovi opterećenja kao što je 6-minutni test hoda mogu otkriti da su pacijenti teže ograničeni nego što bi to sugerirala početna procjena. Testovi hodanja mogu biti korisni za procjenu invaliditeta i rizika od smrtnosti i koriste se za procjenu učinkovitosti plućne rehabilitacije (43).
Terapija
Farmakološka terapija KOPB-a usmjerena je ka smanjenju simptoma, smanjenju učestalosti i težine egzacerbacija, te poboljšanju tolerancije vježbanja i zdravstvenog statusa. Pojedinačna klinička ispitivanja nisu bila dovoljno uvjerljiva kako bi pokazala da farmakoterapija može smanjiti stopu pada FEV1. Međutim, sustavni pregled koji kombinira podatke iz 9 studija pokazao je smanjenje stope pada FEV1 od 5,0 mL/godišnje u skupinama aktivnog liječenja u usporedbi s placebom (44). Razlika između bolesnika liječenih dugodjelujućim bronhodilatatorom i onih koji su dobivali placebo iznosila je 4,9 mL/god. Razlika između skupina liječenih inhalacijskim kortikosteroidom i skupina liječenih placebom iznosila je 7,3 mL/god. Iako su poznate potencijalne koristi farmakoterapije u smanjenju stope opadanja plućne funkcije potrebna su daljnja istraživanja kako bi se znalo koji bi pacijenti od nje mogli imati koristi. Izbor lijeka za liječenje KOPB-a ovisi o dostupnosti i cijeni lijekova te kliničkom odgovoru u odnosu na nuspojave. Svaki tretman treba biti individualan ovisno o procjeni ozbiljnosti simptoma, opstrukcije protoka zraka i težine egzacerbacija koji se razlikuju među pacijentima.
Bronhodilatatori su lijekovi koji mijenjaju tonus glatke muskulature dišnih putova i poboljšavaju ekspiratorni protok dilatacijom dišnih putova. Bronhodilatatori imaju tendenciju smanjenja dinamičke hiperinflacije u mirovanju i tijekom vježbanja i poboljšanja izvedbe vježbanja. Opseg tih promjena, posebno u bolesnika s teškim i vrlo teškim KOPB-om, nije lako predvidjeti iz poboljšanja FEV1 izmjerenog u mirovanju (45). Krivulje doza-odgovor bronhodilatatora (promjena FEV1) su podjednake u svim klasama bronhodilatatora (46). Povećanje doze bilo beta-2 agonista ili antikolinergika, osobito kada se daje lijek u obliku „raspršivača“ Čini se da donosi subjektivnu korist u akutnim epizodama, ali nije nužno od pomoći u stabilnoj bolesti. U bolesnika s KOPB-om najčešće se daju redovito dugodjelujući bronhodilatatori kako bi smanjili simptome i spriječili pogoršanja, a uporaba kratkodjelujućih bronhodilatatora obično se preporučuje po potrebi.
Glavno djelovanje beta-2 agonista je opuštanje glatkih mišića dišnih putova stimulacijom beta-2 adrenergičkih receptora, što povećava ciklički AMP i stvara funkcionalni antagonizam bronhokonstrikciji. Postoje kratkodjelujući (SABA) i dugodjelujući (LABA) beta-2 agonisti. Učinak SABA-e obično nestaje unutar 4 do 6 sati. Redovita i simptomatska uporaba SABA-e poboljšava FEV1 i simptome. LABA pokazuje trajanje djelovanja od 12 ili više sati. Formoterol i salmeterol su LABA lijekovi koji se uzimaju dvaput dnevno i koje značajno poboljšavaju FEV1 i plućni volumen, smanjuju dispneju, stopu egzacerbacija i broj hospitalizacija, ali nemaju utjecaja na smrtnost ili stopu propadanja plućne funkcije (47). Indakaterol je LABA lijek koji se uzima jednom dnevno i poboljšava dispneju, zdravstveno stanje i učestalost egzacerbacija (48). Oladaterol i vilanterol su također LABA lijekovi koji se uzimaju jednom dnevno i koji poboljšavaju funkciju pluća i simptome (49). Stimulacija beta-2 adrenergičkih receptora može izazvati sinusnu tahikardiju u mirovanju i može precipitirati poremećaje srčanog ritma kod osjetljivih pacijenata. Pretjerani je somatski tremor problematičan kod nekih starijih osoba liječenih višim dozama beta-2 agonista, bez obzira na način primjene. Blagi pad parcijalnog tlaka kisika (PaO2) može se pojaviti nakon primjene i SABA-e i LABA-e, ali je klinički značaj ovih promjena neizvjestan. Unatoč prethodnoj zabrinutosti u vezi s upotrebom beta-2 agonista u liječenju astme, nema povezanosti između uporabe beta-2 agonista i gubitka funkcije pluća ili povećane smrtnosti kod KOPB-a (50).
Antimuskarinski lijekovi blokiraju bronhokonstriktorne učinke acetilkolina na M3 muskarinske receptore izražene u glatkim mišićima dišnih putova. Kratkodjelujući antimuskarinici (SAMA) blokiraju inhibitorni neuronski receptor M2 koji potencijalno može uzrokovati vagalno induciranu bronhokonstrikciju. Dugodjelujući muskarinski antagonisti (LAMA) kao što su tiotropij, aklidinij, glikopironijev bromid (glikopirolat) i umeklidinij produljeno se vežu za M3 muskarinske receptore, uz bržu disocijaciju od M2 muskarinskih receptora, čime se produljuje trajanje bronhodilatatorskog učinka (51). Sustavni pregled randomiziranih kontroliranih ispitivanja zaključio je da ipratropij, kratkodjelujući antagonist muskarina, sam pruža male prednosti u odnosu na beta-2 agonist kratkog djelovanja u smislu funkcije pluća, zdravstvenog stanja i potrebe za oralnim kortikosteroidima. Među LAMA lijekovima, neki se daju jednom dnevno (tiotropij i umeklidinij), drugi dva puta dnevno (aklidinij), a neki su odobreni za doziranje jednom dnevno u nekim zemljama i dva puta dnevno u drugima (glikopirolat). LAMA tretmani poboljšavaju simptome, uključujući kašalj i iskašljaj te zdravstveni status. Oni također poboljšavaju učinkovitost plućne rehabilitacije i smanjuju egzacerbacije i povezane hospitalizacije (52). Klinička ispitivanja pokazala su veći učinak na stope egzacerbacija za LAMA liječenje (tiotropij) naspram LABA liječenja (53). Inhalacijski antikolinergički lijekovi slabo se apsorbiraju što ograničava problematične sistemske učinke opažene kod atropina. Opsežna uporaba ove skupine lijekova u širokom rasponu doza i kliničkih okruženja pokazala je da su vrlo sigurni. Glavna je nuspojava suhoća usta. Iako su prijavljeni povremeni urinarni simptomi, nema podataka koji bi dokazali pravi uzročno-posljedični odnos. Neki pacijenti koji koriste ipratropij prijavljuju gorak, metalni okus. Prijavljen je mali porast kardiovaskularnih događaja u bolesnika s KOPB-om koji su redovito liječeni ipratropijevim bromidom (54). Postoje manje dostupni sigurnosni podaci za druge LAMA-e, ali čini se da je stopa antikolinergičkih nuspojava za lijekove u ovoj klasi niska i općenito slična.
Kombinacija bronhodilatatora s različitim mehanizmima i trajanjem djelovanja može povećati stupanj bronhodilatacije s manjim rizikom od nuspojava u usporedbi s povećanjem doze jednog bronhodilatatora. Kombinacije SABA-e i SAMA-e su superiornije u usporedbi pojedinačnim komponentama u poboljšanju FEV1 i simptoma. Liječenje formoterolom i tiotropijem u odvojenim inhalatorima ima veći utjecaj na FEV1 od liječenja samo jednim od navedenih lijekova (55). Dostupne su brojne kombinacije LABA-e i LAMA-e u jednom inhalatoru. Ove kombinacije poboljšavaju funkciju pluća u usporedbi s placebom. U jednom kliničkom ispitivanju liječenje kombinacijom LABA+LAMA imalo je veće poboljšanje u pogledu kvalitete života u usporedbi s placebom kao i njegovim pojedinačnim komponentama bronhodilatatora u bolesnika s velikim početnim opterećenjem simptomima (56). Jedno je kliničko ispitivanje pokazalo da kombinacija LABA+LAMA poboljšava funkciju pluća i simptome, u usporedbi s monoterapijom, pojedinim komponentama dugodjelujućih bronhodilatatora u simptomatskih bolesnika s niskim rizikom od pogoršanja i koji u liječenju nemaju inhalacijski kortikosteroid (57).
Većina studija s kombinacijama LABA+LAMA provedena je u bolesnika s niskom stopom egzacerbacija. Jedna je studija u bolesnika s egzacerbacijama pokazala da je u sprječavanju egzacerbacija učinkovitija kombinacija dugodjelujućih bronhodilatatora od monoterapije dugodjelujućih bronhodilatatora (58). Još jedna studija, također u bolesnika s egzacerbacijama u anamnezi, pokazala je da kombinacija LABA+LAMA smanjuje egzacerbacije u većoj mjeri nego kombinacija LABA+ICS (59). Međutim, studija na populaciji bolesnika s KOPB-om s visokim rizikom od egzacerbacije, pokazala je da je kombinacija LABA+ICS bila učinkovitija u smanjenju egzacerbacija nego kombinacija LABA+LAMA ukoliko su bili povišeni eozinofili u krvi (60). Jedna je randomizirana studija pronašla sličnu učinkovitost LABA+LAMA i LABA+ICS, ali nađen je značajno veći rizik od upale pluća u onih liječenih LABA+ICS (61). Klinička važnost ovog učinka još nije u potpunosti utvrđena. In vivo podaci sugeriraju da su odnosi doze i odgovora i dugoročna (> 3 godine) sigurnost ICS-a u osoba s KOPB-om nejasni i zahtijevaju daljnje istraživanje. Budući da se učinci ICS-a u KOPB-u mogu modulirati pomoću istodobne primjene dugodjelujućih bronhodilatatora, ove dvije terapijske mogućnosti raspravljaju se odvojeno. I sadašnji i bivši pušači s KOPB-om imaju koristi od primjene ICS-a u smislu funkcije pluća i stope egzacerbacija, iako je veličina učinka manja kod teških ili sadašnjih pušača u usporedbi s lakim ili bivšim pušačima (60). Većina je studija pokazala kako redovito liječenje samim ICS-om ne mijenja dugoročni pad FEV1 niti mortalitet u osoba s KOPB-om. Studije i meta-analize koje procjenjuju učinak redovitog liječenja samo ICS-om na mortalitet u osoba s KOPB-om nisu pružile uvjerljive dokaze o dobrobiti istoga (62). U studiji TORCH, trend veće smrtnosti primijećen je u bolesnika liječenih samo flutikazonpropionatom u usporedbi s onima koji su primali placebo ili kombinaciju salmeterola i flutikazonpropionata (63). U umjerenom KOPB-u, flutikazonfuroat je sam ili u kombinaciji s vilanterolom bio povezan sa sporijim padom FEV1 u usporedbi s placebom ili samim vilanterolom u prosjeku 9 ml/god (64). U bolesnika s umjerenim do vrlo teškim KOPB-om i egzacerbacijama, ICS u kombinaciji s LABA-om je učinkovitiji od bilo koje komponente samostalno u pogledu poboljšanja funkcije pluća, zdravstvenog stanja i smanjenja egzacerbacija. Većina je studija pokazala povoljan učinak kombinacije fiksne doze LABA+ICS u odnosu na samu LABA na stopu egzacerbacija, a bili su uključeni pacijenti s poviješću barem jedne egzacerbacije u prethodnoj godini (65). Niz studija je pokazao kako broj eozinofila u krvi predviđa učinak ICS-a u sprječavanju budućih egzacerbacija (60). Postoji proporcionalni odnos između broja eozinofila u krvi i učinka ICS-a, odnosno nema učinka ili je malen kad imamo manji broj eozinofila, dok se učinak postupno povećava pri većem broju eozinofila. Modeliranje podataka pokazuje da režimi liječenja koji uključuju ICS imaju mali ili nikakav učinak ukoliko je broj eozinofila u krvi < 100 stanica/µL te se ovaj prag može koristiti za identifikaciju pacijenata koji neće imati koristi od liječenja ICS-om (66). Osim toga, niži eozinofili u krvi i sputumu povezani su s većom prisutnošću proteobakterija, posebice Haemophilus, te povećane bakterijske infekcije i upale pluća. Niži broj eozinofila u krvi može identificirati pojedince s profilima mikrobioma povezanim s povećanim rizikom od kliničkih pogoršanja uzrokovanih patogenim bakterijama. Prag broja eozinofila u krvi ≥ 300 stanica/µL identificira vrh proporcionalnog odnosa između eozinofila i ICS-a i može se koristiti za identifikaciju bolesnika s najvećom vjerojatnošću koristi od liječenja ICS-om. Veći broj eozinofila u krvi kod pacijenata s KOPB-om povezan je s povećanim eozinofilima u plućima i višom razinom markera upale tipa 2 u dišnim putovima (67). Pragove od < 100 stanica/µL i ≥ 300 stanica/µL treba smatrati orijentacijskim procjenama, a ne preciznim graničnim vrijednostima koje mogu predvidjeti različite vjerojatnosti koristi liječenja ICS-om.
Učinak je liječenja kombinacijskim lijekovima koji sadrže ICS (LABA+LAMA+ICS i LABA+ICS) naspram dualnog bronhodilatacijskog (LABA+LAMA) bolji u bolesnika s visokim rizikom egzacerbacije (≥ 2 egzacerbacije i/ili 1 hospitalizacija u prethodnoj godini) (59). Broj eozinofila u krvi za predviđanje učinaka ICS-a uvijek treba kombinirati s kliničkom procjenom rizika od egzacerbacije na što ukazuje prethodna povijest egzacerbacija. Smatra se da čimbenici kao što su pušački status, etnička pripadnost i geografski položaj mogu utjecati na odnos učinka ICS-a i broja eozinofila u krvi te je to predmet za daljnje istraživanje. Broj eozinofila u krvi može pomoći kliničarima da procijene korist dodavanja ICS-a osnovnom liječenju bronhodilatatorima, a treba se koristiti kao biomarker zajedno s kliničkom procjenom pri donošenju odluka o upotrebi ICS-a. Nema dovoljno dokaza glede korištenja broja eozinofila u krvi za predviđanje budućeg rizika od egzacerbacije KOPB-a neovisno o kliničkim pokazateljima. Veći pad FEV1 u bolesnika s blagim do umjerenim KOPB-om primijećen je u onih s višim brojem eozinofila u krvi u slučajevima kada je uporaba ICS-a bila niska. Korist broja eozinofila u krvi kao prognostičkog biomarkera za opadanje plućne funkcije ističe se u situacijama kada on nije promijenjen primjenom ICS-a (68). Čimbenici koje treba uzeti u obzir pri odluci o započinjanju liječenja ICS-om u kombinaciji s jednim ili dva dugodjelujuća bronhodilatatora su: povijest hospitalizacija zbog egzacerbacije KOPB-a, dvije ili više egzacerbacije u prošloj godini, eozinofili u krvi ≥ 300 stanica/µL te povijest ili usporedno postojanje astme. Postoje visokokvalitetni dokazi iz randomiziranih kontroliranih studija da uporaba ICS-a mijenja mikrobiom dišnih putova i povezuje se s većom prevalencijom oralne kandidijaze, promuklim glasom, modricama na koži i upalom pluća (62). Veći rizici od nastanka upale pluća zbog uporabe ICS-a uključuju: aktivno pušenje, dob višu od 55 godina, povijest prethodnih egzacerbacija ili upale pluća, indeks tjelesne mase (BMI) < 25 kg/m2, izraženu dispneju i opstrukciju protoka zraka u plućima (69). Rezultati studija u kojima je prekinuto liječenje ICS-om su nejasni u pogledu učinka na funkciju pluća, simptome i egzacerbacije (70). Neke od studija su pokazale porast egzacerbacija i simptoma nakon ukidanja ICS-a, dok druge nisu. Studija koja je pratila ukidanje ICS-a i prelazak na dvojnu bronhodilatatornu terapiju pokazala je da su i gubitak FEV1 i povećanje učestalosti egzacerbacija povezani s ukidanjem ICS-a najveći u bolesnika s brojem eozinofila u krvi ≥ 300 stanica/µl (71).
Prelazak na liječenje trojnom terapijom (LABA+LAMA+ICS) može se dogoditi različitim pristupima i pokazalo se da poboljšava funkciju pluća, zadovoljstvo pacijenata i smanjuje egzacerbacije u usporedbi s monoterapijom LAMA ili dvojnim kombinacijama (LABA+LAMA i LABA+ICS) (60). Post-hoc objedinjena analiza tri klinička ispitivanja trostruke terapije u bolesnika s KOPB-om s teškom opstrukcijom protoka zraka i poviješću egzacerbacija pokazala je neznačajan trend niže smrtnosti s trostrukom inhalacijskom terapijom u usporedbi s tretmanima koji ne uključuju ICS (72).
Promjene u GOLD-u 2023.
Neke od ključnih promjena u izvješću GOLD-a iz 2023. uključuju revidiranu definiciju KOPB-a: „KOPB je heterogeno plućno stanje obilježeno kroničnim respiratornim simptomima (dispneja, kašalj, stvaranje sputuma, egzacerbacije) zbog abnormalnosti dišnih putova (bronhitis, bronhiolitis) i/ili alveole (emfizem) koji uzrokuju trajnu, često progresivnu opstrukciju protoka zraka.“
U prvom poglavlju izvješća naglašava se potreba i nove mogućnosti ranijeg dijagnosticiranja i odgovarajućeg liječenja KOPB-a. Ukazuje se na bolesnike koji imaju strukturne plućne lezije i fiziološke abnormalnosti bez opstrukcije protoka zraka koji su kategorizirani kao oni koji imaju „prekursorsko“ stanje prije KOPB-a.
U drugom se poglavlju raspravlja o dijagnozi i procjeni težine KOPB-a, a prethodni alat za početnu procjenu i početak farmakološkog liječenja ABCD promijenjen je u ABE. Skupine A i B su nepromijenjene, ali su skupine C i D spojene u jednu skupinu E kako bi se istaknula klinička važnost egzacerbacija. Pacijenti kategorizirani u skupinu A imaju modificiranu ljestvicu dispneje (mMRC) od 0 do 1, rezultat testa za procjenu KOPB-a (CAT) < 10 i povijest nijedne ili jedne umjerene egzacerbacije koja nije dovela do hospitalizacije. Bolesnici u skupini B imaju mMRC rezultat ≥ 2, CAT rezultat ≥ 10 i povijest nijedne ili jedne umjerene egzacerbacije koja nije dovela do hospitalizacije. Bolesnici u skupini E imaju povijest ≥ 2 umjerene egzacerbacije ili ≥ 1 egzacerbacije koja je dovela do hospitalizacije, bez obzira na njihove mMRC ili CAT rezultate.
U četvrtom se poglavlju raspravlja o liječenju stabilnog KOPB-a, a dodan je i novi tekst o poželjnom početnom izboru kombinacije LAMA+LABA s obzirom na to da je prisutan veliki teret simptoma dispneje kod većine pacijenata koji koriste monoterapiju LAMA ili LABA. Ističe se da kombinacija LABA+ICS ne bi trebala biti preferirani izbor u KOPB-u. LABA+ICS je stoga uklonjen iz preporučenih početnih tretmana, a s LABA+LAMA bi se trebalo započeti kod pacijenata u skupinama B i E. Algoritam također preporučuje razmatranje LABA+LAMA+ICS za pacijente u skupini E ako imaju broj eozinofila u krvi ≥ 300 stanica po μL, upravo zbog pozitivnog učinka trojnog liječenja na smrtnost u ovoj podskupini pacijenata. Čimbenici koje treba uzeti u obzir u uključivanju u liječenje ICS-om u kombinaciji s jednim ili dva dugodjelujuća bronhodilatatora su povijest ranijih hospitalizacija zbog egzacerbacije KOPB-a, broj egzacerbacije (dvije ili više u protekloj godini), broj eozinofila u krvi (≥ 300 stanica/µL), te povijest ili usporedno postojanje astme (73).
LITERATURA
- Celli B, Fabbri L, Criner G, et al. Definition and Nomenclature of Chronic Obstructive Pulmonary Disease: Time for its Revision. Am J Respir Crit Care Med 2022.
- Agusti A, Melen E, DeMeo DL, Breyer-Kohansal R, Faner R. Pathogenesis of chronic obstructive pulmonary disease: understanding the contributions of gene-environment interactions across the lifespan. Lancet Respir Med 2022; 10(5): 512-24.
- Yang IA, Jenkins CR, Salvi SS. Chronic obstructive pulmonary disease in never-smokers: risk factors, pathogenesis, and implications for prevention and treatment. Lancet Respir Med 2022; 10(5): 497-511.
- Cho MH, Hobbs BD, Silverman EK. Genetics of chronic obstructive pulmonary disease: understanding the pathobiology and heterogeneity of a complex disorder. Lancet Respir Med 2022; 10(5): 485-96.
- Martinez FJ, Agusti A, Celli BR, et al. Treatment Trials in Young Patients with Chronic Obstructive Pulmonary Disease and Pre-Chronic Obstructive Pulmonary Disease Patients: Time to Move Forward. Am J Respir Crit Care Med 2022; 205(3): 275-87.
- Wan ES, Castaldi PJ, Cho MH, et al. Epidemiology, genetics, and subtyping of preserved ratio impaired spirometry (PRISm) in COPDGene. Respir Res 2014; 15(1): 89.
- Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380(9859): 2095-128.
- Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380(9859): 2163-96.
- Stern DA, Morgan WJ, Wright AL, Guerra S, Martinez FD. Poor airway function in early infancy and lung function by age 22 years: a non-selective longitudinal cohort study. Lancet 2007; 370(9589): 758-64.
- Tashkin DP, Altose MD, Bleecker ER, et al. The lung health study: airway responsiveness to inhaled methacholine in smokers with mild to moderate airflow limitation. The Lung Health Study Research Group. Am Rev Respir Dis 1992; 145(2 Pt 1): 301-10.
- Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006; 3(11): e442.
- Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006; 28(3): 523-32.
- Quach A, Giovannelli J, Cherot-Kornobis N, et al. Prevalence and underdiagnosis of airway obstruction among middleaged adults in northern France: The ELISABET study 2011-2013. Respir Med 2015; 109(12): 1553-61.
- Ntritsos G, Franek J, Belbasis L, et al. Gender-specific estimates of COPD prevalence: a systematic review and metaanalysis. Int J Chron Obstruct Pulmon Dis 2018; 13: 1507-14.
- Divo MJ, Celli BR, Poblador-Plou B, et al. Chronic Obstructive Pulmonary Disease (COPD) as a disease of early aging: Evidence from the EpiChron Cohort. PLoS One 2018; 13(2): e0193143.
- World Health Organization. Evidence-Informed Policy Network: EVIPnet in Action [accessed Oct 2022]. https://www.who.int/initiatives/evidence-informed-policy-network.
- Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007; 370(9589): 741-50.
- Jensen HH, Godtfredsen NS, Lange P, Vestbo J. Potential misclassification of causes of death from COPD. Eur Respir J 2006; 28(4): 781-5.
- Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007; 370(9589): 741-50.
- Kessler R, Partridge MR, Miravitlles M, et al. Symptom variability in patients with severe COPD: a pan-European crosssectional study. Eur Respir J 2011; 37(2): 264-72.
- Montes de Oca M, Perez-Padilla R, Talamo C, et al. Acute bronchodilator responsiveness in subjects with and without airflow obstruction in five Latin American cities: the PLATINO study. Pulm Pharmacol Ther 2010; 23(1): 29-35.
- Miravitlles M, Worth H, Soler Cataluna JJ, et al. Observational study to characterise 24-hour COPD symptoms and their relationship with patient-reported outcomes: results from the ASSESS study. Respir Res 2014; 15: 122.
- Mullerova H, Lu C, Li H, Tabberer M. Prevalence and burden of breathlessness in patients with chronic obstructive pulmonary disease managed in primary care. PLoS One 2014; 9(1): e85540.
- Lapperre T, Bodtger U, Kjærsgaard Klein D, et al. Dysfunctional breathing impacts symptom burden in Chronic Obstructive Pulmonary Disease (COPD). European Respiratory Journal 2020; 56(suppl 64): 124.
- Vidotto LS, Carvalho CRF, Harvey A, Jones M. Dysfunctional breathing: what do we know? J Bras Pneumol 2019; 45(1): e20170347.
- Medical Research Council Committee on the Aetiology of Chronic Bronchitis. Definition and classification of chronic bronchitis for clinical and epidemiological purposes. A report to the Medical Research Council by their Committee on the Aetiology of Chronic Bronchitis. Lancet 1965; 1(7389): 775-9.
- Brusse-Keizer MG, Grotenhuis AJ, Kerstjens HA, et al. Relation of sputum colour to bacterial load in acute exacerbations of COPD. Respir Med 2009; 103(4): 601-6.
- Blakemore A, Dickens C, Chew-Graham CA, et al. Depression predicts emergency care use in people with chronic obstructive pulmonary disease: a large cohort study in primary care. Int J Chron Obstruct Pulmon Dis 2019; 14: 1343-53.
- Goertz YMJ, Looijmans M, Prins JB, et al. Fatigue in patients with chronic obstructive pulmonary disease: protocol of the Dutch multicentre, longitudinal, observational FAntasTIGUE study. BMJ Open 2018; 8(4): e021745.
- von Haehling S, Anker SD. Cachexia as a major underestimated and unmet medical need: facts and numbers. J Cachexia Sarcopenia Muscle 2010; 1(1): 1-5.
- Hanania NA, Mullerova H, Locantore NW, et al. Determinants of depression in the ECLIPSE chronic obstructive pulmonary disease cohort. Am J Respir Crit Care Med 2011; 183(5): 604-11.
- Holleman DR, Jr., Simel DL. Does the clinical examination predict airflow limitation? JAMA 1995; 273(4): 313-9.
- Guder G, Brenner S, Angermann CE, et al. “GOLD or lower limit of normal definition? A comparison with expert-based diagnosis of chronic obstructive pulmonary disease in a prospective cohort-study”. Respir Res 2012; 13(1): 13.
- Vaz Fragoso CA, McAvay G, Van Ness PH, et al. Phenotype of normal spirometry in an aging population. Am J Respir Crit Care Med 2015; 192(7): 817-25.
- Vaz Fragoso CA, McAvay G, Van Ness PH, et al. Phenotype of Spirometric Impairment in an Aging Population. Am J Respir Crit Care Med 2016; 193(7): 727-35.
- Hansen JE, Porszasz J. Counterpoint: Is an increase in FEV(1) and/or FVC >/= 12% of control and >/= 200 mL the best way to assess positive bronchodilator response? No. Chest 2014; 146(3): 538-41.
- American Thoracic Society (ATS). Lung function testing: selection of reference values and interpretative strategies. American Thoracic Society. Am Rev Respir Dis 1991; 144(5): 1202-18.
- Balasubramanian A, MacIntyre NR, Henderson RJ, et al. Diffusing Capacity of Carbon Monoxide in Assessment of COPD. Chest 2019; 156(6): 1111-9.
- Boutou AK, Shrikrishna D, Tanner RJ, et al. Lung function indices for predicting mortality in COPD. Eur Respir J 2013; 42(3): 616-25.
- Harvey BG, Strulovici-Barel Y, Kaner RJ, et al. Risk of COPD with obstruction in active smokers with normal spirometry and reduced diffusion capacity. Eur Respir J 2015; 46(6): 1589-97.
- Casanova C, Gonzalez-Davila E, Martinez-Gonzalez C, et al. Natural Course of the Diffusing Capacity of the Lungs for Carbon Monoxide in COPD: Importance of Sex. Chest 2021; 160(2): 481-90.
- Lacasse Y, Theriault S, St-Pierre B, et al. Oximetry neither to prescribe long-term oxygen therapy nor to screen for severe hypoxaemia. ERJ Open Res 2021; 7(4).
- Celli B, Tetzlaff K, Criner G, et al. The 6-Minute-Walk Distance Test as a Chronic Obstructive Pulmonary Disease Stratification Tool. Insights from the COPD Biomarker Qualification Consortium. Am J Respir Crit Care Med 2016; 194(12): 1483-93.
- Celli BR, Anderson JA, Cowans NJ, et al. Pharmacotherapy and Lung Function Decline in Patients with Chronic Obstructive Pulmonary Disease. A Systematic Review. Am J Respir Crit Care Med 2021; 203(6): 689-98.
- Berger R, Smith D. Effect of inhaled metaproterenol on exercise performance in patients with stable “fixed” airway obstruction. Am Rev Respir Dis 1988; 138(3): 624-9.
- Chrystyn H, Mulley BA, Peake MD. Dose response relation to oral theophylline in severe chronic obstructive airways disease. BMJ 1988; 297(6662): 1506-10.
- Kew KM, Mavergames C, Walters JA. Long-acting beta2-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2013; 10(10): CD010177.
- Geake JB, Dabscheck EJ, Wood-Baker R, Cates CJ. Indacaterol, a once-daily beta2-agonist, versus twice-daily beta(2)- agonists or placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2015; 1: CD010139.
- Koch A, Pizzichini E, Hamilton A, et al. Lung function efficacy and symptomatic benefit of olodaterol once daily delivered via Respimat(R) versus placebo and formoterol twice daily in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis 2014; 9: 697-714.
- McGarvey L, Niewoehner D, Magder S, et al. One-Year Safety of Olodaterol Once Daily via Respimat(R) in Patients with GOLD 2-4 Chronic Obstructive Pulmonary Disease: Results of a Pre-Specified Pooled Analysis. COPD 2015; 12(5): 484-93.
- Melani AS. Long-acting muscarinic antagonists. Expert Rev Clin Pharmacol 2015; 8(4): 479-501.
- Karner C, Chong J, Poole P. Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014; 7(7): CD009285.
- Vogelmeier C, Hederer B, Glaab T, et al. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med 2011; 364(12): 1093-103.
- Anthonisen NR, Connett JE, Enright PL, Manfreda J, Lung Health Study Research G. Hospitalizations and mortality in the Lung Health Study. Am J Respir Crit Care Med 2002; 166(3): 333-9.
- Tashkin DP, Pearle J, Iezzoni D, Varghese ST. Formoterol and tiotropium compared with tiotropium alone for treatment of COPD. COPD 2009; 6(1): 17-25.
- Martinez FJ, Fabbri LM, Ferguson GT, et al. Baseline Symptom Score Impact on Benefits of Glycopyrrolate/Formoterol Metered Dose Inhaler in COPD. Chest 2017; 152(6): 1169-78.
- Maltais F, Bjermer L, Kerwin EM, et al. Efficacy of umeclidinium/vilanterol versus umeclidinium and salmeterol monotherapies in symptomatic patients with COPD not receiving inhaled corticosteroids: the EMAX randomised trial. Respir Res 2019; 20(1): 238.
- Wedzicha JA, Decramer M, Ficker JH, et al. Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double-blind, parallel-group study. Lancet Respir Med 2013; 1(3): 199-209.
- Wedzicha JA, Banerji D, Chapman KR, et al. Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016; 374(23): 2222-34.
- Lipson DA, Barnhart F, Brealey N, et al. Once-Daily Single-Inhaler Triple versus Dual Therapy in Patients with COPD. N Engl J Med 2018; 378(18): 1671-80.
- Suissa S, Dell’Aniello S, Ernst P. Comparative Effectiveness and Safety of LABA-LAMA vs LABA-ICS Treatment of COPD in Real-World Clinical Practice. Chest 2019; 155(6): 1158-65.
- Yang IA, Clarke MS, Sim EH, Fong KM. Inhaled corticosteroids for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012; 7(7): CD002991.
- Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356(8): 775-89.
- Calverley PMA, Anderson JA, Brook RD, et al. Fluticasone Furoate, Vilanterol, and Lung Function Decline in Patients with Moderate Chronic Obstructive Pulmonary Disease and Heightened Cardiovascular Risk. Am J Respir Crit Care Med 2018; 197(1): 47-55.
- Nannini LJ, Lasserson TJ, Poole P. Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus longacting beta(2)-agonists for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012; 9(9): CD006829.
- Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med 2018; 6(2): 117-26.
- George L, Taylor AR, Esteve-Codina A, et al. Blood eosinophil count and airway epithelial transcriptome relationships in COPD versus asthma. Allergy 2020; 75(2): 370-80.
- Tan WC, Bourbeau J, Nadeau G, et al. High eosinophil counts predict decline in FEV1: results from the CanCOLD study. Eur Respir J 2021; 57(5).
- Crim C, Dransfield MT, Bourbeau J, et al. Pneumonia risk with inhaled fluticasone furoate and vilanterol compared with vilanterol alone in patients with COPD. Ann Am Thorac Soc 2015; 12(1): 27-34.
- Nadeem NJ, Taylor SJ, Eldridge SM. Withdrawal of inhaled corticosteroids in individuals with COPD–a systematic review and comment on trial methodology. Respir Res 2011; 12: 107.
- Chapman KR, Hurst JR, Frent SM, et al. Long-Term Triple Therapy De-escalation to Indacaterol/Glycopyrronium in Patients with Chronic Obstructive Pulmonary Disease (SUNSET): A Randomized, Double-Blind, Triple-Dummy Clinical Trial. Am J Respir Crit Care Med 2018; 198(3): 329-39.
- Vestbo J, Fabbri L, Papi A, et al. Inhaled corticosteroid containing combinations and mortality in COPD. Eur Respir J 2018; 52(6): 1801230.